CRISPR/Cas9 muterede zebrafisk på Frederiksberg Campus
For at øge viden om genernes rolle har en gruppe forskere på KU implementeret CRISPR/Cas9 mutations-teknologien i zebrafisk.

Vi ved efterhånden alle sammen, at en sund tarmflora er vigtig for helbredet. Der er ofte meget fokus på, hvordan man kan påvirke denne tarmflora ved hjælp af kost og livsstil men nyere forskning tyder på, at vores egne gener også spiller en vigtig rolle. Hvilken rolle vides dog kun i begrænset omfang. Forskere på KU har nu givet sig i kast med at undersøge sagen og til formålet har de implementeret CRISPR/Cas9 mutations-teknologien i zebrafisk. De har lagt ud med at lave albinoer ved at slå et gen i stykker, der er ansvarligt for pigmentering.
Med et værktøj som CRISPR/Cas 9 kan man relativt let inducere mutationer og lave rene avlslinjer med den ønskede mutation. Det er meget anvendeligt for forskellige undersøgelser og kan anvendes specielt til funktionelle studier, hvor man undersøger responser i organismen med og uden det protein, som genet koder for.
Hvorfor bruge zebrafisk?
Zebrafisken er blevet en meget populær modelorganisme både i forhold til sygdomme i mennesker og almindelige biologiske mekanismer såsom udvikling og genetik. Zebrafisken har en kæmpe fordel i forhold til mus, som er det mest brugte forsøgsdyr. Det skyldes, at fiskens udvikling går hurtigt og at genetisk manipulation er relativt simpel, da fosterudviklingen i fiskeægget foregår uden for en livmoder. To dage efter befrugtning er en hel lille ny fisk udviklet med øjne, hjerne, lever og et bankende hjerte. Tre måneder senere er fiskene kønsmodne og klar til at føre slægten videre.
De små fiskelarver er gennemsigtige, og man kan dermed se ind i alle organer og dokumentere processer i fisken mens den er i live. Ligesom med mus er der lavet rigtigt mange genmodificerede zebrafisk (GMO) og mange af dem er baseret på, at fisken er gennemsigtig i det tidlige stadium. Derfor har receptorer, vævstyper eller immunceller eksempelvis fået indsat en fluorescensmarkør, så man kan observere og dokumentere disse targets og deres respons på forskellige manipulationer i levende fisk.
CRISPR/Cas9-teknikken
Kort fortalt, så sætter forskerne avlspar sammen en aften lige inden lyset slukker. Når lyset tændes næste morgen, vil avlsparrene producere befrugtede æg som skal indsamles med det samme, da reaktionsmikset helst skal sprøjtes ind i ægget på 1-cellestadiet. Derfor har forskerne kun ca. 30 min til at sprøjte reaktionsmikset - en blanding af guideRNA og Cas9-proteinet - ind i blommesækken i ægget.
Inde i ægget dirigerer guideRNA Cas9-proteinet hen til det nøjagtige sted på DNA-strengen, hvor Cas9 kløver det dobbeltstrengede DNA og dermed klipper i genomet. Dagen efter frasorteres døde æg. Efter endnu en dag vil en fænotypisk mutation, som skabelsen af albinoer, vise sig i fostrene og man kan nøjes med at beholde de muterede fisk. Nogle mutationer vil ikke kunne ses med det blotte øje og derfor skal der laves analyser på gen-sekvenserne. Fire dage efter befrugtning samples 5 genmodificerede larver og 5 kontrollarver til genetisk analyse. Hvis det viser sig, at mutationerne ikke er lykkedes, prøver man bare igen, da zebrafiske-avlspar kan producere op til 300 befrugtede æg om ugen. For at identificere gode forældrefisk til en ren linje, skal det påvirkede gen undersøges i individer, hvorefter de bedste udvælges.
Hvad får forskerne på KU ud af det?
Formålet med implementeringen af denne teknik er at være i stand til at slå gener i stykker, der koder for noget, som påvirker mikrobiomet på og i fiskene. I albinoerne kan forskerne undersøge om dannelse af pigment påvirker mikrobiomet på overfladen af fisken, og senere vil forskerne slå andre gener i stykker, der har indflydelse på tarm-mikrobiomet. De vil begynde dette ved at slå et gen i stykker, der koder for interferon-regulatorisk faktor 8 (Irf8), som en underpopulation af makrofager er afhængig af. Det vil altså sige, at denne underpopulation af makrofager ikke vil blive dannet i de genmanipulerede fisk og det totale antal makrofager vil mindskes. Forskerne tror på, at denne manipulation vil påvirke sammensætningen af bakterier i tarmen. Mikrobiomet i tarmsystemet i zebrafisk er afhængigt af forskellige faktorer, og påvirkning fra makrofager spiller højst sandsynligt en rolle. Resultaterne vil således være med til at øge vores viden omkring hvordan værtsfiskens egen genetiske profil påvirker dens tarmflora, og give et hint om hvorledes vores egne gener kunne påvirke tarmfloraen i mennesker.
CRISPR-fiskene på Frederiksberg
Forskerne har transgene linjer af zebrafisk gående på Frederiksberg Campus, bl.a. forskellige linjer med fluorescensmærkede neutrofiler, makrofager og endothelceller. De vil benytte en transgen linje med fluorescensmærkede makrofager (Figur 2), hvor Irf8 genet vil blive slået i stykker med CRISPR/Cas9. Makrofager er en bestemt type immunceller, hvis rolle bl.a. er at bekæmpe ubudne gæster. Ved hjælp af disse transgene zebrafisk kan forskerne kvantificere nedgangen i makrofager ved at tælle cellerne under mikroskop. En kvantificering af makrofager er ikke lige til, så der skal også laves baggrundsarbejde med at analysere genetikken på de muterede fisk.
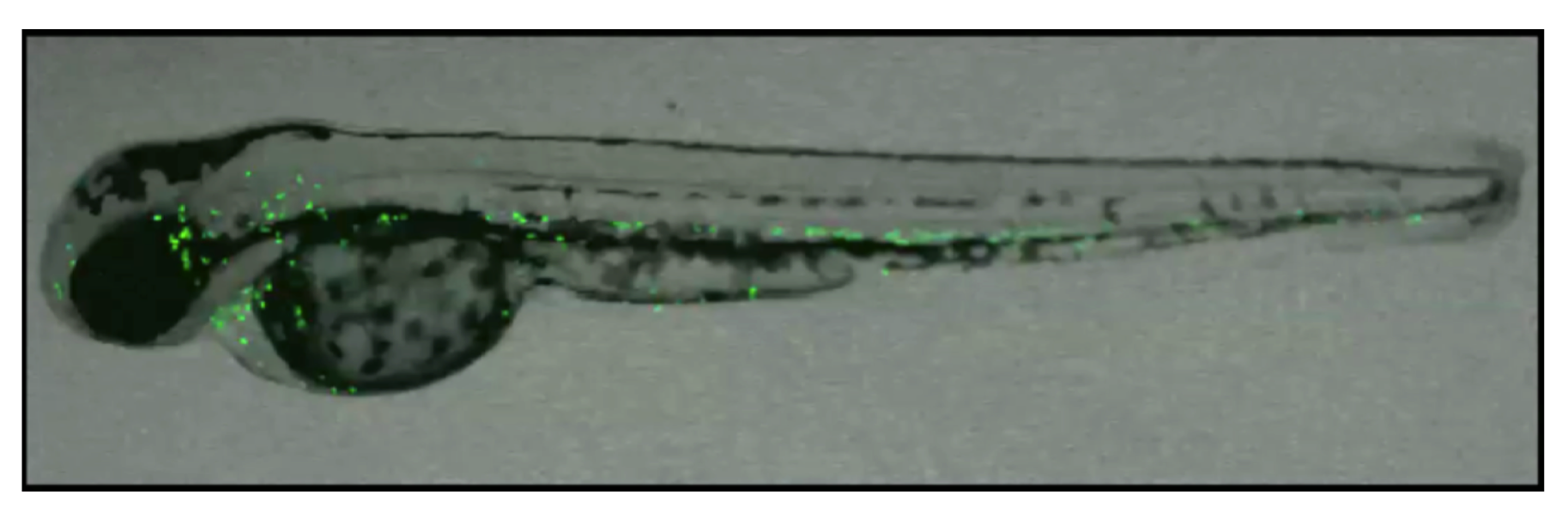
Denne nye CRISPR/Cas9 teknik kan bidrage til, at man på KU på en simpel måde kan lave mutationer i zebrafisk og undersøge relevante biologiske funktioner for ens forskningsprojekt. Immunsystemets celler og funktioner er ofte de samme hos fisk og mennesker, og selvom der er forskelle, kan disse basale funktioner og immunologiske pathways og mekanismer undersøges i zebrafisk og bruges til videre forskning i pattedyr.
CRISPR-fiskene er lavet af Louise von Gersdorff Jørgensen og Moonika Haahr Marana, Afdeling for Akvatisk Patobiologi.
Kontaktperson:
Lektor Louise von Gersdorff Jørgensen
lvgj@sund.ku.dk
Mobil: 22833464
CRISPR-fiskene er et samarbejde mellem forskellige forskergrupper på KU:
GLOBE, Center for Evolutionary Hologenomics - Morten Tønsberg Limborg (PI), morten.limborg@sund.ku.dk
IVH, Parasitology and Aquatic Pathobiology - Louise von Gersdorff Jørgensen
Arbejdet er støttet af Det Frie Forskningsråd via projektet HOSTgutINTERACT (#9128-00003).
